新型コロナウイルス感染症の流行をきっかけに、社会全体で感染症予防への関心と日常の衛生意識が高まっています。私たちは、こうした社会の変化を受けて、人々が安心して清潔な生活を送れるように、微生物制御に有効な成分や作用メカニズムを解明するとともに、ウイルスに対する効果的な制御手段の確立に向けた研究を進めています。
ウイルスは、エンベロープと呼ばれる脂質膜の有無により、エンベロープ型(インフルエンザウイルスなど)と、ノンエンベロープ型(ノロウイルスなど)の2タイプに分けられます。エンベロープ型ウイルスは、脂質膜をアルコール類や洗浄剤に含まれる界面活性剤で容易に破壊できるため、比較的不活化しやすいことが知られています。一方、ノンエンベロープ型ウイルスは表面が「カプシド」と呼ばれるタンパク質の殻で構成されています。この強固なカプシドタンパク質を化学的に破壊するには酸化力の高い次亜塩素酸Na(塩素系漂白剤)による不活化が主流ですが、不活化方法は限られており、新たな対策法の開発が求められています。本研究では、タンパク変性の効果が高いとされるカチオン界面活性剤と塩の共存によってノンエンベロープ型ウイルスの不活化効果を増強する可能性を探りました。
ノンエンベロープ型ウイルスに対する研究を行うにあたり、ノロウイルスの代替ウイルスであるネコカリシウイルス(FCV)を用いることにしました。今回は、日常的に使用され安全性が高く、界面活性剤の作用に影響を与えることが知られている「塩」に着目し、カチオン界面活性剤へ塩を添加した際のウイルスに対する不活化効果を検証しました。
カチオン界面活性剤には、低濃度でもウイルス不活化効果を示し、殺菌剤や消毒剤として使用される塩化ジデシルジメチルアンモニウム (DDAC)を使用しました。Na+を含むさまざまな塩を添加し、各陰イオン種のウイルス不活化効果への影響を評価しました。
ウイルス不活化効果の示し方
ウイルス不活化効果は「⊿log(デルタログ)」という数値で示され、これはウイルスがどれだけ減少したかを表します。この⊿logは、処理前と処理後のウイルスの量の差を、対数(log、ログ)で計算したもので、⊿log = 1の場合はウイルスの90%が不活化、⊿log = 2の場合はウイルスの99%が不活化されたことを意味します。トイレや衣服等に使用される洗浄剤などでウイルスに対する効果を訴求する場合は、ウイルスを99%以上の不活化、すなわち⊿logの値が2以上であることが必要となります(※1)。
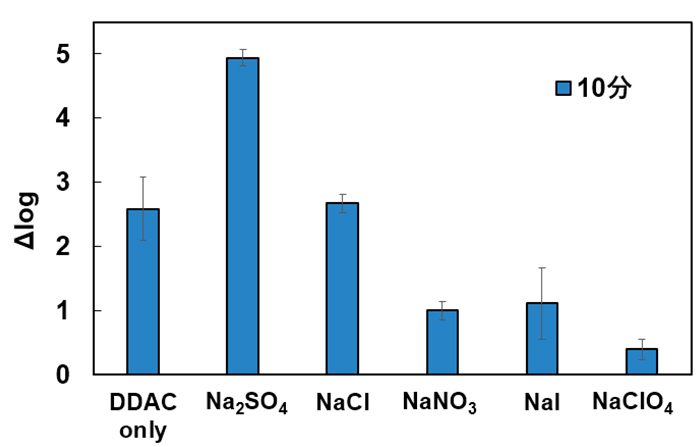
評価の結果、DDAC 単独(Fig.1の“DDAC only”)でも不活化効果は⊿log>2 を示しました。DDAC にNa2SO4を添加すると不活化効果は⊿log≧5へと向上し、不活化効果の増強が認められました(Fig.1の“Na2SO4”)。また別の実験にて、添加した塩単独では不活化効果がないことを確認しています。DDACに加えた塩によるウイルスの不活化増強効果は、陰イオン種がSO42-、Cl-、NO3-、I-、CIO4-の順に高く、これはイオンの塩析効果(※2)の強弱を示すホフマイスター順列(※3)と一致しました。以上のことから、塩析効果の高いSO42-は、DDACとタンパク質との結合に影響を与えていることが考えられました。
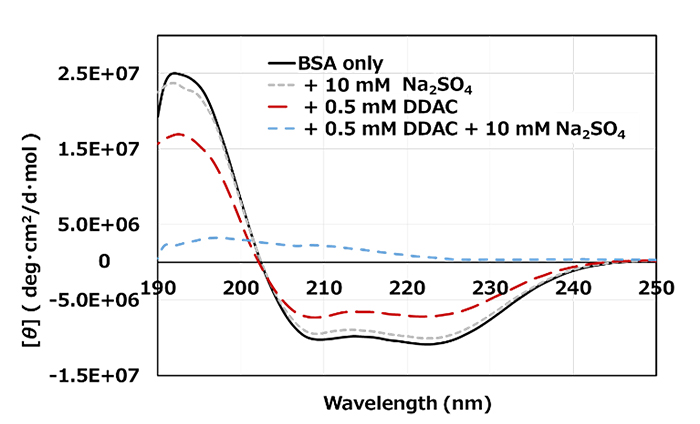
ノンエンベロープ型ウイルスは、前述の通り強固なカプシド(タンパク質の殻)を有しています。そこで、DDACとSO42-の共存が、FCVのカプシドのタンパク質をどのように変性させて、不活化効果を発揮するかの可能性を検証することにしました。実験に使用するタンパク質としては、界面活性剤によるタンパク質変性の研究で一般的に使用されるウシ血清アルブミン(BSA)を用い、タンパク質の構造解析に用いられる円二色性(Circular Dichroism: CD)スペクトルを測定しました。CDスペクトルは、光の性質を使ってタンパク質がどのような形状(らせん状、シート状などの立体構造の形)であるかが分かる評価方法です。DDACとSO42-が共存することで、タンパク質の立体構造がどのように変化するかを評価しました。
その結果、BSA単体時(Fig.2 黒線)、BSAにNa2SO4単体添加時(Fig.2 灰色点線)ならびにBSAにDDAC単体添加時(Fig.2 赤色点線)においては、スペクトルの変動が見られたものの大きな形状の変化は確認できませんでした。一方、BSAにDDACとNa2SO4を添加(Fig.2 水色点線)した時は、スペクトルの形状が大きく変化し、さらにこの時のみ、溶液が白濁し、BSA-DDACと想定される複合体の析出が肉眼でも確認されました。以上のことから、DDACとSO42-の共存が相乗的にBSAのタンパク質の構造に影響を与え、大きな変性を引き起こしたと考えられます。
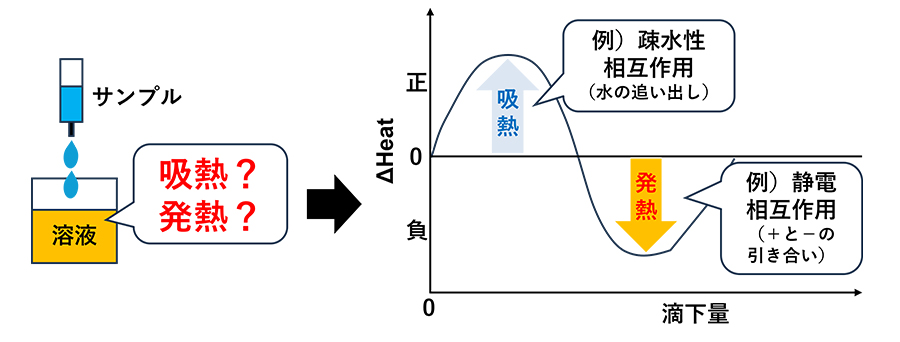
さらなるメカニズム解明のため、等温滴定型熱量計(Isothermal Titration Calorimetry:ITC)を用いて、Na2SO4の有無によるDDACとBSAの結合の様子の違いを検討しました。ITCは、分子同士が結合・乖離する際に生じる「熱の出入り」を測る装置です。グラフがプラスの値を示す場合は、疎水性相互作用を代表とする吸熱反応が、マイナスの値を示す場合は、静電相互作用を代表とする発熱反応が起きていることを示します。この熱の変化パターンから、分子間に働く力の種類や、結合の状態を解析しました(Fig.3)。
まず、BSAに対してDDACのみを滴下した場合(Fig.4図の左側)には、0.05mM付近と、DDACの臨界ミセル濃度(Critical Micelle Concentration:CMC)(※4)である0.44mM付近の2か所で吸熱ピークが確認されました(Fig.4図の左側の□印)。これは、DDAC添加直後からBSAにDDACが1分子(単分子)ずつ吸着してDDACの炭素鎖とBSAの疎水部による吸熱が生じ、その後、CMC付近ではBSA表面に吸着しているDDACに対して、さらにDDACが集合(会合吸着)することにより吸熱が発生したと考えられます。CMC以降では、BSA内部の疎水部分が表面に露出するなどの構造変化が生じ、BSA同士の凝集による吸熱反応および、BSA複合体表面への水分子の再配列に伴う水和による発熱反応が同時に進行し、吸熱から発熱に転じたと考えられます。
次に、BSAにNa2SO4を加えた溶液に対してDDACを滴下したところ(Fig.4図の右側)、低濃度域の吸熱ピークの立ち上がりが大きくなり、CMCおよび発熱に転じる濃度が低濃度側へシフトしました(Fig.4の図の右側の青色○印)。これは、「BSAへのDDAC単分子ずつの吸着」と「DDACの会合吸着」がほぼ同時に進行したことによると考えられ、低濃度の時点からBSA の構造変化がNa2SO4の共存で促進されたと推察されます。図には示していませんが、BSA にNa2SO4のみを滴下した際には熱量変化が検出されませんでした。このことから、SO42-がBSAと直接的に結合するのではなく、Na2SO4は、BSAの周囲の水分子を奪う「塩析効果」によってBSAの構造変化を促進したものと考えられます。
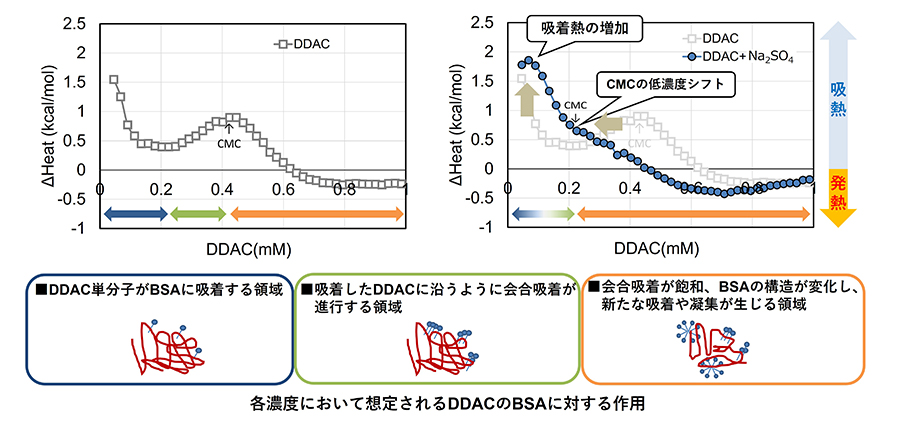
ITCの測定結果をまとめると、DDACはまず単分子として BSA に吸着し、その後ミセル形成に伴ってBSAの構造を変化させます。硫酸イオン(SO42-)が存在すると、より低濃度の段階からミセル形成が始まり、BSAの構造変化が促進されることが明らかになりました。DDAC と SO42-の相乗効果は、BSAだけでなく、ノンエンベロープ型ウイルスの強固なカプシド構造に対しても同様に作用すると考えられ、ITCの結果は、先に示したDDACとNa2SO4との共存によるウイルス不活化効果の増強を裏付けるものと言えます。
今回の研究成果から、カチオン界面活性剤と特定の塩の相乗効果により、従来難しいとされてきたノンエンベロープ型ウイルスの不活化を効率的に増強する可能性が示されました。引き続き、他の界面活性剤や添加成分との組み合わせの効果を探求し、ウイルス不活化技術の確立を目指して研究を進めていきます。
1) Rei S. et al. Sys Rev Pharm. 13 (11), 751-755(2022)
2) Koichiro A. J. Jpn. Oil. Chem. Soc. 34 (9), 718-729(1985)
3) 竹田 邦雄ら, オレオサイエンス 11(1), 3-10(2011)